§ 22. ИДЕАЛЬНЫЙ ГАЗ. ОСНОВНОЕ
УРАВНЕНИЕ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ ТЕОРИИ ГАЗОВ.
Давление идеального газа пропорционально произведению
концентрации молекул на их среднюю кинетическую энергию.
Газ окружает нас со всех сторон.
В любом месте на земле, даже под водой, мы носим на себе часть атмосферы, нижние
слои которой сжимаются под действием силы тяжести верхних. Поэтому, измеряя атмосферное
давление можно судить о том, что происходит высоко над нами и предсказывать
погоду. Что же такое давление газа, и как крошечные молекулы воздуха его
создают?
Давлением p на данном участке поверхности, называют отношение силы F, действующей перпендикулярно этой поверхности
к площади S данного её участка (см. рис.22а):

Единицей измерения давления в
СИ служит Паскаль (Па). 1 Па = 1 Н/м2.
Чтобы объяснить, как
молекулы газа могут оказывать давление на поверхности, огранивающие его объём,
допустим, что расстояние между молекулами намного превышает их размеры, и поэтому
молекулы не взаимодействуют между собой, а лишь время от времени сталкиваются,
как упругие шарики, и при этом их общая кинетическая энергия сохраняется. Такой
газ называют идеальным.
Найдём силу F, с которой действует молекула массой
m0 на поверхность, от которой она
отскакивает (см. рис. 22б). При отражении от поверхности, длящемся
промежуток времени Dt, составляющая скорости молекулы,
перпендикулярная этой поверхности, vy изменяется на обратную
(-vy). Поэтому при отражении от поверхности
молекула приобретает импульс, 2m0vy , а значит, по третьему закону
Ньютона (см. также 14.1) 2m0vy =FDt, откуда:

Формула (22.2) даёт возможность
вычислить силу, с которой давит одна молекула газа на стенку сосуда в течение
интервала Dt. Чтобы определить среднюю силу
давления газа, например, за одну секунду, надо найти, сколько
молекул отразится за секунду от участка поверхности площадью S, а также необходимо знать среднюю
величину скорости vy молекул, движущихся в направлении к
данной поверхности.
Пусть в единице объёма
газа находится n молекул. Упростим себе задачу, считая, что все молекулы газа
движутся с одинаковой скоростью, v. При этом 1/3 всех молекул движется
вдоль оси Ox, и столько же – вдоль оси Oy и Oz (см. рис. 22в). Пусть половина
молекул, движущихся вдоль оси Oy, движется в сторону стенки С, а остальные – в противоположную сторону. Тогда,
очевидно, количество молекул в единице объёма, несущихся в сторону стенки С, составит n/6.
Найдём теперь количество
молекул, ударившихся об участок поверхности площадью S (заштрихован на рис. 22в) за
одну секунду. Очевидно, что за 1 с до
стенки успеют долететь те молекулы, которые движутся в её сторону и находятся
на расстоянии, не большем v. Поэтому ударятся об этот участок поверхности 1/6
всех молекул, находящихся в прямоугольном параллелепипеде, выделенном на рис.
22в, длина которого равна v, а площадь торцевых граней - S.
Так как объём этого параллелепипеда составляет Sv, то общее число N молекул, ударившихся об участок
поверхности стенки за 1 с будет равно:

Используя
(22.2) и (22.3) можно вычислить импульс, который за 1 с
сообщил молекулам газа участок поверхности стенки
площадью S. Этот импульс численно будет равен силе давления газа, F:
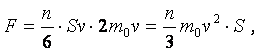
откуда,
используя (22.1), получаем следующее выражение, связывающее давление газа и
среднюю кинетическую энергию поступательного движения его молекул:
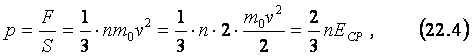
где ЕСР –
средняя кинетическая энергия молекул идеального газа. Формулу (22.4) называют основным
уравнением молекулярно-кинетической теории газов.
Вопросы для
повторения:
·
Дайте определение идеального газа?
·
Почему давление газа оказывается пропорциональным квадрату
скорости его молекул?
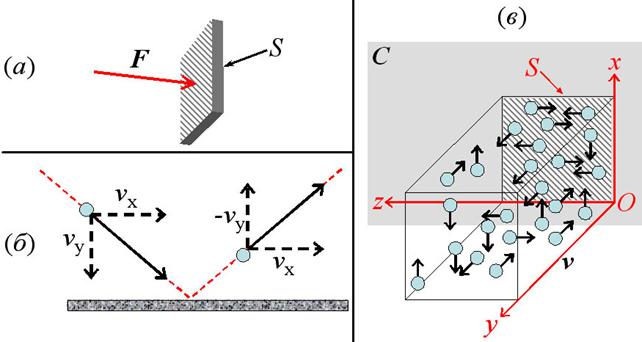
Рис. 22.
(а) – к определению величины давления; (б) - к вычислению формулы
(22.2); (в) - к вычислению формулы (22.3).