§ 24.
УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА. ЗАКОН АВОГАДРО
Уравнение состояния идеального газа связывает между
собой три его макроскопические характеристики – занимаемый газом объём, его
давление и температуру.
В §23 мы вывели формулу, связывающую
давление идеального газа, p, концентрацию молекул в нём, n, и его абсолютную температуру, Т:
p = nkT
, (24.1)
где k – постоянная
Больцмана. Однако в большинстве случаев пользоваться формулой (24.1) неудобно,
т.к. величина n, как правило, неизвестна, а мы лишь знаем, какой это газ и
какой объём он занимает. Чтобы в этих случаях формулой
(24.1) было пользоваться проще, преобразуем её следующим образом. Пусть газ,
состоящий из N молекул, находится в сосуде объёмом V. Тогда концентрация, n молекул равна:
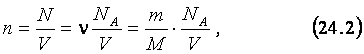
где m и n - масса и количество вещества,
содержащееся в газе с молярной массой M и объёмом V, а
NA – число Авогадро (см. 19.1 и 19.2).
Подставляя (24.2) в (24.1), получаем:
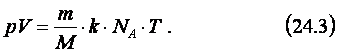
Произведение kNA обозначают буквой R и называют универсальной
(молярной) газовой постоянной, которая равна 8,31 Дж/(моль.К). Заменяя kNA на R в формуле (24.3), получаем:
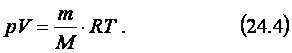
Уравнение
(24.4) называют уравнением состояния идеального газа или уравнением
Менделеева-Клапейрона, названным в честь русского учёного Д.И. Менделеева
и французского физика Б. Клапейрона. Формула (24.4) определяет взаимозависимость
трёх макроскопических характеристик данной массы газа, определяющих его
состояние, – давления, объёма и температуры.
Уравнение
Менделеева-Клапейрона позволяет вычислить одну из пяти переменных (p, V, m, M и T), если значения остальных четырёх
известны. Можно, например, найти молярную массу, М
газа, т.е. определить его относительную молекулярную массу, если измерить его
давление, объём, массу и температуру.
Из уравнения (24.4)
следует, что если данная масса газа находится в состоянии 1, в котором
её давление, объём и температуры равны p1, V1 и T1, соответственно, а потом переходит в состояние 2
(см. рис. 24а), в котором её давление, объём и температуры становятся
равными p2,
V2 и T2, то:

Уравнение
(24.5), называемое уравнением Клапейрона, позволяет вычислить значение одной
из макроскопических характеристик газа в состоянии 2, если остальные две
известны.
Возьмём одинаковое число молей n двух
разных газов (А и Б). Пусть эти газы имеют одинаковую температуру
T0 и давление p0. Тогда из уравнения (24.4) следует, что объёмы этих
газов, VА и VБ, тоже равны:

Таким образом, при
одинаковых давлении и температуре равные объёмы
различных газов содержат одинаковое количество вещества, т.е. молекул. Этот
вывод называют законом Авогадро. Из закона Авогадро и формулы (24.6)
следует, что при нормальных условиях, т.е. при температуре 0оС
(Т0=273 К) и нормальном атмосферном
давлении (p0=101325
Па), газ, взятый в количестве 1 моль, занимает объём 0,0224 м3 или
22,4 литра (см. рис. 24б).
Вопросы для
повторения:
·
Сформулируйте уравнение Менделеева-Клапейрона. Для каких
газов оно справедливо?
·
Как связана универсальная газовая
постоянная с постоянными Больцмана и Авогадро?
·
Сформулируйте закон Авогадро.
·
Какие объёмы занимает один, два и три моля идеального газа
при нормальных условиях?
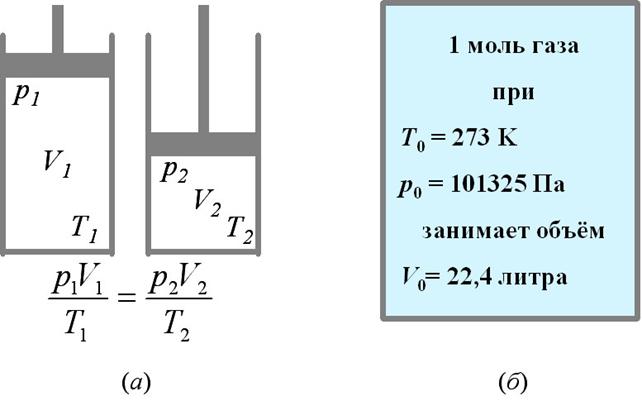
Рис. 24.
(а) – связь между параметрами газа в двух его состояниях; (б) –
связь между параметрами одного моля газа при нормальных условиях.