§ 25.
ИЗОПРОЦЕССЫ В ГАЗАХ. ГАЗОВЫЕ ЗАКОНЫ.
Из уравнения Менделеева - Клапейрона следуют законы,
по которым изменяется состояние газов, когда один из параметров – температура,
давление или объём остаются неизменным.
В большинстве случаев при
переходе газа из одного состояния в другое меняются все его параметры –
температура, объём и давление. Так происходит, когда газ сжимается под поршнем
в цилиндре двигателя внутреннего сгорания, в результате чего температура газа и
его давление растут, а объём уменьшается. Однако в некоторых случаях изменения
одного из параметров газа относительно малы или вообще отсутствуют. Такие
процессы, где один из трёх параметров – температура, давление или объём
остаются неизменными, называют изопроцессами, а законы, которые их
описывают – газовыми законами.
Изотермическим
процессом называют
изменение состояния газа, при котором его температура остаётся постоянной.
Примером такого процесса может служить накачивание воздухом автомобильных шин.
Однако изотермическим такой процесс можно считать, если сравнивать состояние
воздуха перед тем, как он оказался в насосе, с его состоянием в шине после
того, как температура шины и окружающего воздуха стали равными. Любые медленные
процессы, происходящие с малым объёмом газа, окружённым большой массой газа,
жидкости или твёрдого тела, имеющей постоянную температуру, можно считать изотермическими.
Из уравнения состояния
идеального газа (24.4) следует, что при изотермическом процессе произведение
давления данной массы газа на его объём есть величина постоянная. Этот закон,
называемый законом Бойля-Мариотта, был открыт английским учёным Р.
Бойлем и французским физиком Э. Мариоттом и записывается в следующем виде:
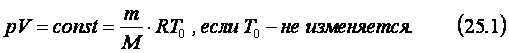
График,
иллюстрирующий, как изменяется давление газа в зависимости от его объёма при
изотермическом процессе, называют изотермой и
имеет вид гиперболы (см. рис. 25а). Видно, что расширение газа при
изотермическом процессе сопровождается падением его давления.
Изобарным процессом называют изменение состояния газа,
происходящее при постоянном давлении. Согласно уравнению Менделеева-Клапейрона (24.4) при
изобарном процессе отношение объёма данной массы газа к его температуре
постоянно. Этот вывод, который называют законом Гей-Люссака в честь
французского учёного Ж. Гей-Люссака, можно записать в виде:
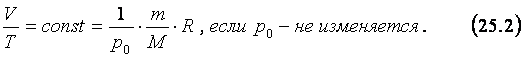
График,
показывающий, как объём газа зависит от его температуры при изобарическом
процессе, называют изобарой, которая, как видно на рис. 25б,
является прямой, проходящей через начало координат. На самом деле, при достаточно
низких температурах все газы превращаются в жидкости, к которым газовые законы
уже неприменимы. Поэтому изобары на рис. 25б вблизи начала координат
показаны пунктиром.
Одним
из примеров изобарного процесса является расширение маленьких пузырьков воздуха
и углекислого газа, содержащихся в тесте, когда его ставят в духовку. Давление
воздуха внутри духовки и снаружи одинаково, а температура внутри приблизительно
на 50% больше, чем снаружи. Согласно закону Гей-Люссака объём газовых пузырьков
в тесте вырастает тоже на 50% , что и делает пирог воздушным.
Процесс,
при котором изменяется состояние газа, а его объём остаётся неизменным, называют
изохорным. Из уравнения Менделеева - Клапейрона следует, что у газа,
занимающего постоянный объём, отношение его давления к температуре тоже должно
быть постоянным:
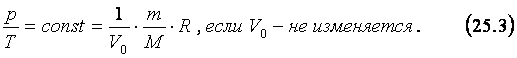
Уравнение (25.3) описывает закон Шарля, с
которым мы уже встречались ранее (см. 23.1). Зависимость между давлением и
температурой газа при изохорном процессе называют изохорой, которая
является прямой (см. рис. 25в).
Вопросы для
повторения:
·
Что такое изопроцессы и газовые законы? Перечислите их и
приведите примеры их применения.
·
Как газовые законы следуют из уравнения состояния идеального
газа?
·
Почему медленные процессы почти всегда можно считать
изотермическими?
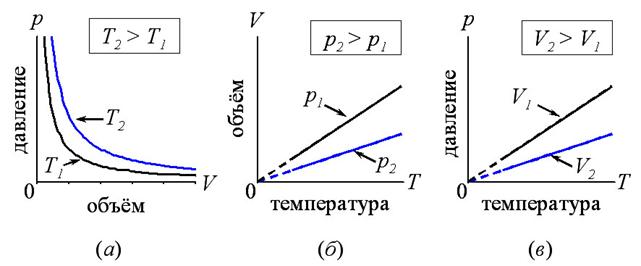
Рис. 25. а,
б, в – изотермы, изобары и изохоры идеального
газа, соответственно.