§ 30. ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ.
Энергия замкнутой системы взаимодействующих между собой
тел, зависящая от их скоростей, положения, температуры, формы, химического
состава и т.п., остаётся неизменной.
Молекулярная физика
объясняет свойства тела, рассматривая движение молекул или атомов, из которых
оно состоит, и взаимодействие между ними. Однако во многих случаях характеристики
движения и взаимодействия между частицами тела остаются неизвестными, и тогда
для описания свойств тела используют его макроскопические параметры, например,
давление, внутреннюю энергию, температуру и объём. Раздел физики, изучающий
тепловые процессы без использования характеристик движения и взаимодействия
молекул или атомов, называют термодинамикой. Закон сохранения и
превращения энергии в замкнутых системах применительно к тепловым явлениям
называют первым законом термодинамики. Этот закон впервые был сформулирован
немецкими учёными Г. Гельмгольцем и Р. Майером, а также английским учёным Д.
Джоулем.
На рис. 30а
показана схема экспериментальной установки, которую использовал Джоуль для
демонстрации этого закона термодинамики. Она состояла из теплоизолированного сосуда
с водой, в котором находились лопатки для её перемешивания, приводимые в движение
падающим грузом. Вращение лопаток приводило к нагреву воды. Другими словами,
вращающиеся лопатки совершали работу над водой, и её внутренняя энергия росла.
Таким образом, вся потенциальная энергия груза переходила во внутреннюю энергию
воды, налитой в сосуд. В этих опытах впервые была показана эквивалентность количества
теплоты и энергии. До этого, количество теплоты измеряли термометром, принимая,
например, за единицу одну калорию – количество теплоты, необходимое для нагрева
1 грамма воды на 1 оС. Джоуль показал, что 1 калория равна 4,2 Дж.
Внутренняя энергия любого
тела может изменяться либо путём теплообмена с другими телами, либо в
результате совершения работы над этим телом. Однако согласно первому закону термодинамики
изменение внутренней тела, DU, при переходе из одного состояния в
другое должно быть равно сумме количества теплоты, Q, перешедшего к телу, и работы, А,
совершённой над телом внешними силами. Поэтому первый закон термодинамики применительно
к данному телу может быть записан в следующей форме:
DU = Q + A . (30.1)
Во многих случаях при
переходе из одного состояния в другое само тело совершает работу А1. Так как А1=
-А, то для этих случаев уравнение (30.1) удобно переписать в виде:
Q = DU + A1 . (30.2)
Таким образом, количество теплоты, перешедшее к телу, расходуется на изменение
его внутренней энергии и работу, которую оно совершает.
Первый закон термодинамики делает невозможным
создание вечного двигателя – механизма, способного совершать работу без каких
либо затрат внешней энергии и изменений внутренней энергии механизма. Согласно
уравнению (30.2), если механизм представляет собой замкнутую систему (Q=0), то максимальная работа, которую
он может совершить, равна его внутренней энергии. Поэтому вечные двигатели
невозможны.
Запишем первый закон
термодинамики для идеального газа, расширяющегося под поршнем в изотермическом
процессе. Как было показано в §28, внутренняя энергия идеального газа зависит
только от температуры, а значит, при изотермическом процессе его внутренняя
энергия не изменяется. Подставляя DU=0 в (30.2), получаем, что A1=Q. Таким образом, работа, совершённая расширяющимся
газом при изотермическом процессе, равна количеству теплоты, которое газ получил
извне.
Работа, совершаемая газом
при расширении, зависит от его давления, p, и объёма, V, следующим образом. Пусть газ в
цилиндре расширился, приподняв чуть-чуть поршень на Dh (рис. 30б). Если площадь
поршня равна S, то сила, F, действующая снизу на поршень со
стороны газа, равна pS, и поэтому работа A1, совершаемая газом при движении поршня, составляет:
A1=F.Dh = pS.Dh = p.DV , (30.3)
где DV – изменение объёма газа,
произошедшее при подъёме поршня на Dh. Если построить график зависимости
давления p, газа от его объёма V, между его состояниями 1 и 2 (рис. 30в),
то согласно (30.3) работа, совершаемая газом, при его расширении на DV, будет равна заштрихованной площади
под кривой графика. Тогда очевидно, что работа газа между состояниями 1
и 2 равна площади под всей кривой на графике рис. 30в.
Вопросы для повторения:
·
Что изучает термодинамика?
·
Сформулируйте первый закон термодинамики для тела, которое
или над которым совершают работу.
·
Почему вечный двигатель невозможен?
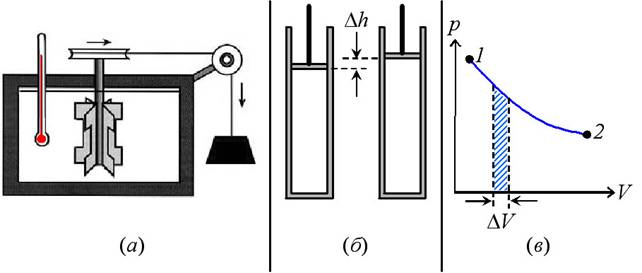
Рис. 30. (а) - экспериментальная установка Джоуля для демонстрации
эквивалентности между количеством теплоты и работы; (б) – к вычислению
работы расширяющегося газа; (в) – то же.