§ 46. ЭЛЕКТРИЧЕСКИЙ ТОК В ЖИДКОСТЯХ.
ЗАКОН ЭЛЕКТРОЛИЗА ФАРАДЕЯ.
Прохождение тока через электролит
сопровождается химическими реакциями на электродах, в результате которых выделяются элементы,
входящие в состав электролита.
Жидкости, как
и твёрдые тела, могут проводить электрический ток. Если переносчиками тока в
жидкости служат ионы, то её проводимость называют ионной, а такую
жидкость – электролитом.
Ионы при
растворении вещества появляются из-за того, что ещё до растворения у многих молекул
одна часть обладает избыточным числом электронов, а в другой части их не
хватает. Такая молекула, бывшая до растворения электрически нейтральной, при
растворении распадается (диссоциирует) на два иона, заряженные равными по
модулю, но противоположными по знаку зарядами. Способствуют этому процессу,
названному электролитической диссоциацией, полярные молекулы
растворителя (например, воды), разрывающие на части (ионы) молекулы
растворённого вещества.
Одновременно
с электролитической диссоциацией идёт процесс рекомбинации – образование
из ионов нейтральных молекул растворённого вещества. Если условия, в которых
находится электролит, остаются неизменны, то скоро
наступает момент, когда число молекул, распадающихся на ионы в единицу времени,
становится равным числу молекул, образовавшихся из ионов в процессе
рекомбинации. Таким образом, наступает динамическое равновесие между диссоциацией
и рекомбинацией, при котором концентрация ионов остаётся
постоянной. При росте температуры динамическое равновесие смещается в сторону
электролитической диссоциации и концентрация ионов в
электролите растёт.
Положительные
и отрицательные ионы в электролите способны
перемещаться независимо друг от друга, участвуя, например, в тепловом движении
(рис. 46а). Однако при таком беспорядочном движении ионов
ток через электролит остаётся равным нулю. Для пропускания тока через
электролит в него погружают проводники (рис. 46б), которые называют
электродами, создавая с их помощью в электролите электрическое поле. При этом
положительный электрод называют анодом, а отрицательный – катодом.
Когда между электродами возникает разность потенциалов, движение ионов становится упорядоченным: отрицательные ионы
движутся к аноду, а положительные – к катоду.
В отличие от электронной, ионная проводимость
сопровождается, переносом вещества (ионов).
Соприкасаясь с катодом, положительные ионы получают от
него недостающие электроны и становятся электрически нейтральными. При соприкосновении
отрицательных ионов с анодом они теряют лишние электроны и тоже становятся
нейтральными атомами или молекулами. Таким образом, ток, проходя через
электролит, приводит к выделению на электродах веществ, входящих в состав
электролита. Это явление и
сопровождающий его процесс разложения электролита при пропускании
электрического тока называют электролизом.
Впервые электролиз исследовал М. Фарадей, который
экспериментально доказал, что масса, выделяющегося на электроде вещества,
пропорциональна величине заряда, протекающего через электролит. Это заключение
называют законом электролиза Фарадея, который сейчас можно легко вывести
теоретически. Пусть в электролите присутствуют положительные и отрицательные ионы с валентностью n. Тогда заряд каждого
положительного иона будет равен ne (e
– элементарный заряд). Если при электролизе через электролит прошёл заряд q,
то очевидно, что число N положительных ионов,
достигших катода равно:
N=q/ne. (46.1)
Каждый из положительных ионов, соприкоснувшись с
катодом, превращается в нейтральную молекулу (или атом). Если молярная масса
вещества, выделяющегося на катоде равна M, то масса mi одной молекулы, ставшей
нейтральной на катоде, равна:
mi =M/NA , (46.2)
где NA - постоянная
Авогадро. Из (46.1) и (46.2) следует, что масса m вещества, выделившегося
на катоде, равна:

Очевидно, что
(46.3) является математической формой записи закона электролиза Фарадея (K –
электрохимический эквивалент вещества).
Электролиз
широко применяется для очистки металлов от примесей. Таким образом
очищают медь и получают алюминий. Кроме того, используя электролиз, можно
покрыть металлические предметы тонким слоем другого металла (никелирование,
хромирование и т.п.).
Вопросы для повторения:
·
Что такое электролитическая диссоциация и электролиз?
·
Сформулируйте закон электролиза Фарадея.
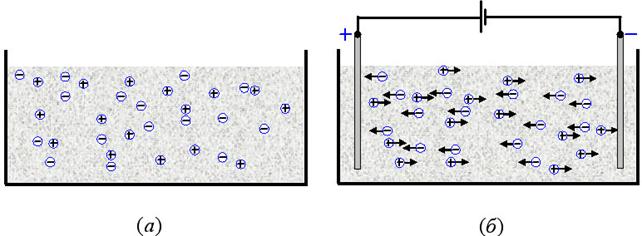
Рис. 46. Хаотичное (а) и упорядоченное движение
ионов электролита в электрическом поле (б).