§ 34. квантовые постулаты бора
Электроны в атоме могут находиться только на разрешённых орбитах, двигаясь по которым они не излучают энергию.
Электроны, обращающиеся вокруг ядра в планетарной модели атома, движутся с ускорением. Согласно законам электродинамики (уравнениям Максвелла) заряды, движущиеся с ускорением, излучают электромагнитные волны, в результате чего их механическая энергия должна уменьшаться. Расчёты показывают, что вращающийся вокруг ядра электрон должен, теряя энергию, приблизиться к ядру и, наконец, упасть на него уже через миллионную долю секунды. В действительности атомы весьма стабильны и, не излучая энергию, могут существовать неограниченно долго. Таким образом, планетарная модель атома противоречит законам классической физики.
В 1913 г. датский физик Н. Бор предложил несколько ограничить
классическую физику, когда её применяют к явлениям, происходящим внутри атома. Чтобы
сделать устойчивой планетарную модель атома Бор ввёл два допущения (постулата),
которые впоследствии были названы постулатами Бора (рис. 34а):
1. Существование стационарных состояний. Атом не излучает и является устойчивым лишь в некоторых стационарных (неизменных во времени) состояниях, каждому из которых соответствует своё "разрешённое" значение энергии En. При этом состояние, соответствующее минимальной энергии атома называют основным, а остальные – его возбуждёнными состояниями. Любое изменение энергии атома связано с квантовым (скачкообразным) переходом из одного стационарного состояния в другое.
2. Условие частот излучения. При переходе из стационарного состояния с большей энергией Ei в стационарное состояние с меньшей энергией Ek атом излучает фотон определённой частоты n, которую можно найти из соотношения: hn = Ei - Ek. Наоборот, находясь в состоянии с энергией Ek и поглощая фотон той же частоты n, атом переходит в состояние с большей энергией Ei.
Оба постулата Бора противоречат законам классической физики. Постулат 1 утверждает, что энергия стационарных состояний атома не может иметь любые значения, что противоречит классической механике. Противоречит этот постулат и классической электродинамике, так как согласно ему электрон, обладая центростремительным ускорением при вращении вокруг ядра, не излучает электромагнитных волн. Постулат 2 тоже противоречит классической электродинамике, так как согласно уравнениям Максвелла частота излучения электрона зависит от характеристик его движения, а не только от изменения энергии атома.
Постулаты Бора позволяют следующим образом объяснить происхождение линейчатых спектров, которые характерны для излучения изолированных атомов. Все атомы одного химического элемента обладают одинаковым набором стационарных состояний (рис 34б). Согласно постулату 2 при переходе этих атомов из стационарного состояния с большей энергией Ei в стационарное состояние с меньшей энергией Ek они излучают электромагнитные волны частотой nik = (Ei - Ek)/h. Так как Ei и Ek для данного химического элемента принимают только определённый ряд значений, то спектр излучения и поглощения этих атомов состоит из дискретного набора определённых частот (рис. 34в), а значит, представляет собой линейчатый спектр. Таким образом, каждый химический элемент характеризуется своим набором частот излучения и поглощения.
Используя свои постулаты, Бор вычислил частоты спектральных линий самого простого атома - атома водорода. Однако, руководствуясь только постулатами Бора, предсказать спектры более сложных атомов, например, гелия, не удаётся. Сделать это помогает квантовая механика, изучение которой выходит за пределы школьного курса физики.
Вопросы для повторения:
·
Какие
состояния атома называют стационарными и возбуждёнными?
·
Сформулируйте
постулаты Бора?
·
Почему
постулаты Бора противоречат законам классической физики?
·
Как
с помощью постулатов Бора объяснить линейчатые спектры атомов?
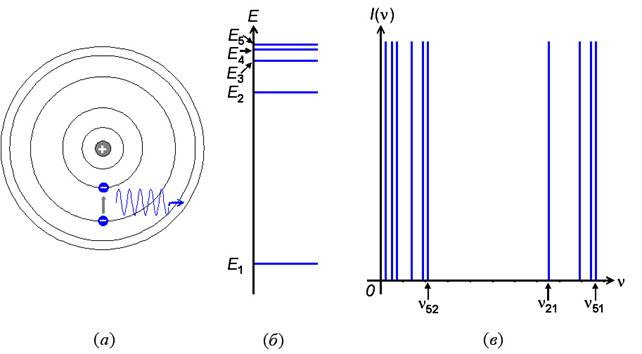
Рис. 34. (а) – схематическое изображение разрешённых орбит электрона, соответствующих стационарным состояниям атома, и кванта излучения при переходе с одной такой орбиты на другую; (б) – схематическое изображение нескольких стационарных состояний атома, характеризуемых его энергией; (в) – спектр излучения атома, стационарные состояния которого показаны на (б).